2022-03-04 13:37来源:互联网作者:上海管理员
摘要:今天给大家介绍下化学中非常重要的一个知识点:Hess’s Law在计算题中的应用,并且对相关知识点的运用进行一下总结,以便在日后的学习和做题中能举一反三。
在A-Level化学第六章节初始,我们会接触到一个概念叫“焓”(Enthalpy),它指的是一份物质所具有的能量,用焓=内能+压强*体积来表示。然而对于焓的理解是比较抽象的,但理解焓的差值“焓变”就容易多了。
很多化学反应,在反应前后会有温度变化,例如木炭燃烧、硝酸铵结冰等。这就代表了吸热或放热反应中的能量得失。这部分能量我们就称之为“焓变”。
例如我们在室外燃烧一小块炭生成CO2放出10kJ热量,那么这部分能量就用∆H来表示,代表燃烧过程中逸散到空气中的热量。反应产生的能量变化可以是不同形式的,包括热量、光、体积变化等等,但这些能量的变化,我们都可以称之为“焓变”。
焓变也有不同的形式,例如反应焓、形成焓、燃烧焓、中和焓和原子化焓等,这些焓有些是可以实际测量的,也有些是我们为了计算而虚构的,实际反应可能并不存在。
那么在引入了焓的概念以及各类焓的定义之后,就来看看他在我们的题目里是怎么应用的吧。在此之前,我们需要理解Hess’s Law是如何运用的。

对于一个化学反应,总能量变化是一定的,无论经过几步反应,或者经过什么反应路径,甚至是虚构的中间步骤。类似于物理或者数学中的向量,无论你经过几个(连续的)步骤,只要起点和终点是相同的,向量和也就相同。
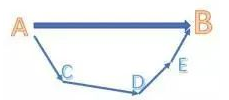
(从图中就能很直观的看出)
下面我们做一道题来尝试一下吧!(题目如下)

在此题中,我们无法直接求得由C4H10的燃烧焓,那么我们就需要走一个弯路,寻求反应物和生成物之间的一个共同终点站B,也就是C、H2和氧气分别形成它们的形成焓∆fHƟ。尽管并不可能用碳粉和氢气氧气来制成丁烷,但在原子数上,ABC确实都保持了平衡,那么这个循环就是成立的。我们来画出一个焓变示意图。
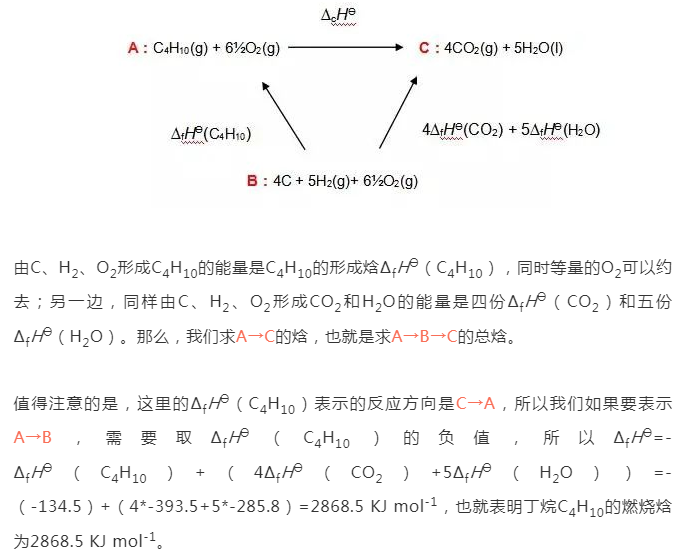
这道题算是一种简单的循环,更复杂的循环会涉及到多步反应和相变,在同学们刷题过程中,如果遇到也不要害怕。注意反应方向和保持元素平衡,即使是十几步反应,也能像拼图一样一步步完整起来。
免费领取最新剑桥雅思、TPO、SAT真题、百人留学备考群,名师答疑,助教监督,分享最新资讯,领取独家资料。
方法1:扫码添加新航道老师

微信号:shnc_2018
方法2:留下表单信息,老师会及时与您联系
免责声明
1、如转载本网原创文章,请表明出处;
2、本网转载媒体稿件旨在传播更多有益信息,并不代表同意该观点,本网不承担稿件侵权行为的连带责任;
3、如本网转载稿、资料分享涉及版权等问题,请作者见稿后速与新航道联系(电话:021-64380066),我们会第一时间删除。
客服热线电话:4008-125-888 总部:北京新航道教育文化发展有限责任公司
总部地址:北京市海淀区学院路7号5层529室 总部电话:400-779-6688
Copyright © www.xhd.cn All Rights Reserved 京ICP备05069206
ICP认证:京ICP备05069206号-5
![]() 京公网安备11010802021513号
京公网安备11010802021513号